La vie ne manque pas de sel, mais parfois de piment… Or j’aime ce qui est fort ! Ce qui pique… Grand consommateur de piments polymorphes et poivres divers, j’apprécie la découverte de ces incendies végétaux et de tout ce qui brûle la langue avec résonance…
Je savais que le piquant du poivre, par exemple, était dû à une molécule particulière, la capsaïcine. Mais ce n’est que récemment que j’ai fait le rapprochement (spatial) avec d’autres substances dont on connait le goût sur la langue. Par exemple L’eugenol des cabinets de dentiste, présent dans des clous de girofle (mais aussi, plus étonnant, dans le basilic), la zingerone du gingembre et, plus surprenant encore, de la vanille !
Mais à quoi sont dues ces similitudes de sensations ? A la stéréochimie ! Laissez moi vous narrer cette belle histoire de molécules…
L’esprit de la vanille
 Car tout commence avec la vanilline, l’un des principes odorant et gustatif de la… vanille. Oui ! Vous voyez, vous êtes chimiste…
Car tout commence avec la vanilline, l’un des principes odorant et gustatif de la… vanille. Oui ! Vous voyez, vous êtes chimiste…
La synthèse industrielle de cette dernière fut d’ailleurs un des grands accomplissements de la chimie organique. Une phase de confiance aveugle et la croyance peut être fausse que demain on fabriquerait n’importe quelle substance naturelle. Avant de se rendre compte que parfois, le tout est plus que la somme des parties…
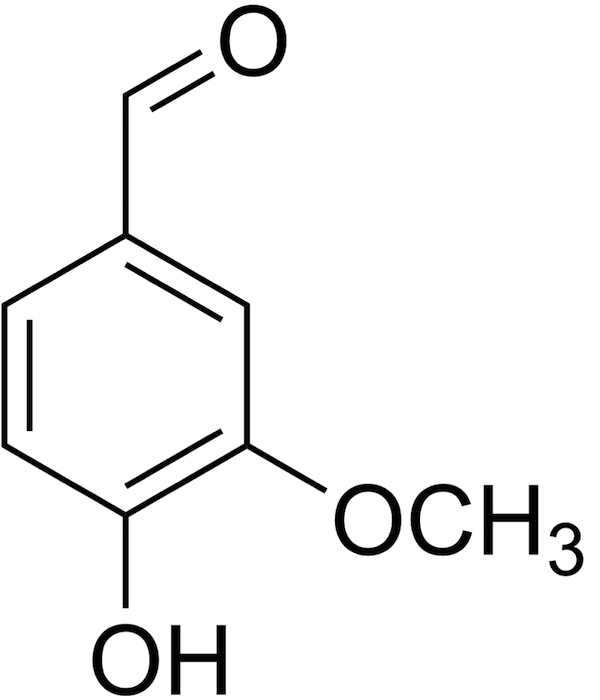 Voilà donc à quoi ressemble cette molécule simple, à l’arôme subtil et pénétrant. Son poids moléculaire est relativement faible ce qui la rend volatile et perceptible à notre odorat.
Voilà donc à quoi ressemble cette molécule simple, à l’arôme subtil et pénétrant. Son poids moléculaire est relativement faible ce qui la rend volatile et perceptible à notre odorat.
Les molécules organiques contenant uniquement carbone et hydrogène sont rarement solubles dans l’eau. Mais la nature est bien faite : les groupes oxygénés (hydroxyle, methoxyle et cétonique) sont capables de créer des liaisons hydrogène avec l’eau. En clair : la vanilline est soluble dans l’eau (environ un gramme pour 100 ml).
C’est d’ailleurs à cette solubilité qu’on doit le bouquet des vins vieillis en fûts de chêne : présente dans la lignite du bois, la vanilline se dissout lentement dans le vin…
Laissons donc la vanilline s’envoler et parfumer l’air pour passer à des drogues plus dures… Car, en rajoutant simplement quelques atomes à la vanilline, en l’occurrence une chaîne hydrocarbonée, on obtient l’eugenol (les clous de girofle des Moluques… Le dentiste !)
Le feu du clou de girofle
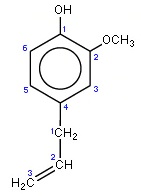 On trouve cette substance également dans beaucoup d’autres plantes. La présence de la chaîne hydrocarbonée la rend beaucoup moins soluble dans l’eau mais par contre soluble dans les graisses ce qui lui permet de pénétrer facilement les tissus (on connait son effet antiseptique et anesthésique…).
On trouve cette substance également dans beaucoup d’autres plantes. La présence de la chaîne hydrocarbonée la rend beaucoup moins soluble dans l’eau mais par contre soluble dans les graisses ce qui lui permet de pénétrer facilement les tissus (on connait son effet antiseptique et anesthésique…).
Cette « queue carbonée » lui confère par ailleurs une odeur plus puissante que la vanilline tout en activant les récepteurs vanillinoïdes présents dans beaucoup de nos muqueuses.
Car, en biochimie, la perception des saveurs et des odeurs est basée sur ce principe de clé et de serrure.
 A cette « clé eugenol » (dont elle a la forme) correspond une autre molécule capable, par sa forme, de l’accueillir et seulement elle. D’où l’importance de la forme de la molécule dans l’espace, sa « stéréochimie« .
A cette « clé eugenol » (dont elle a la forme) correspond une autre molécule capable, par sa forme, de l’accueillir et seulement elle. D’où l’importance de la forme de la molécule dans l’espace, sa « stéréochimie« .
Aussi surprenant que cela puisse paraître, nous possédons au sein de nos diverses cellules spécialisées, quantité de ces récepteurs correspondant pratiquement à toutes les substances naturelles et souvent, plus troublant, de synthèse, c’est à dire n’existant pas dans la nature. Comment expliquer ce paradoxe ? Nul ne le sait !
Poursuivons notre exploration et ajoutons encore des groupements d’atomes à notre « vanilline de base »…
Le brasier du gingembre
 On obtient cette fois la Zingerone, présente dans le gingembre mais aussi dans d’autres plantes, comme dans l’huile de moutarde : tout ce qui pique, quoi…
On obtient cette fois la Zingerone, présente dans le gingembre mais aussi dans d’autres plantes, comme dans l’huile de moutarde : tout ce qui pique, quoi…
Le groupe carbonyle C=O la rend soluble dans l’eau mais le reste de la molécule benzénique et carbonée autorise aussi sa dissolution dans les lipides.
Ceci lui confère aussi son goût encore plus puissant que les précédents qui, nous en avons tous fait l’expérience en mâchonnant cette racine, dure longtemps en bouche.
 Les vertus toniques et thérapeutiques du gingembre ne sont plus à démontrer, ce qu’on explique par son action antioxydante (détruisant les « radicaux libres ») et il serait efficace également contre certains cancers de la peau.
Les vertus toniques et thérapeutiques du gingembre ne sont plus à démontrer, ce qu’on explique par son action antioxydante (détruisant les « radicaux libres ») et il serait efficace également contre certains cancers de la peau.
Mais, revenons à nos poivres et piments, en ajoutant encore à la vanilline d’autres groupements moléculaires et un atome d’azote…
L’incendie du piment
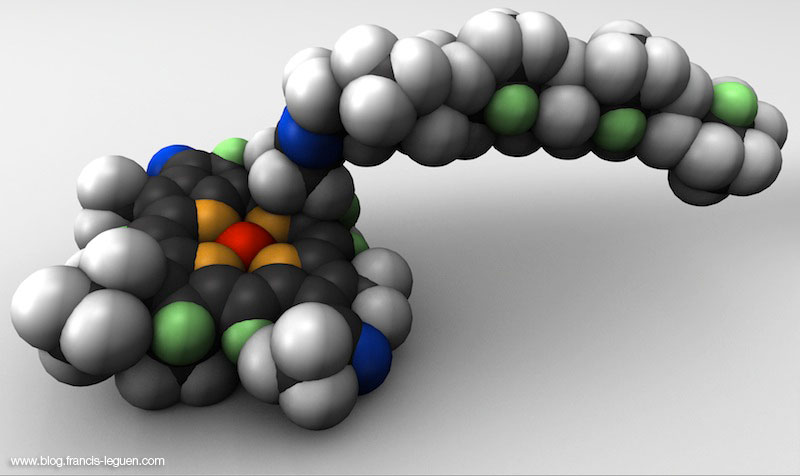
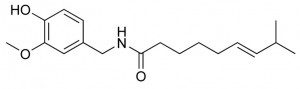 Et voilà la capsaïcine, à la stéréochimie légèrement phallique… Je me demande d’ailleurs bien quelle est la forme du récepteur capable de décrypter ce messager turgescent…
Et voilà la capsaïcine, à la stéréochimie légèrement phallique… Je me demande d’ailleurs bien quelle est la forme du récepteur capable de décrypter ce messager turgescent…
Cette molécule urticante est présente dans tous les piments mais aussi dans l’origan, la cannelle, la coriandre… Son poids moléculaire lui donne une volatilité extrêmement faible ce qui la rend indétectable à notre odorat.
 Mais il n’en va pas de même du goût : une solution en contenant 10 parties par millions provoque une sensation de brulure sur la langue, bien connue. Comme ses consœurs elle est très soluble dans les graisses mais insoluble dans l’eau. Ce qui explique l’inutilité de boire de l’eau lorsqu’on ressent cette fameuse brulure…
Mais il n’en va pas de même du goût : une solution en contenant 10 parties par millions provoque une sensation de brulure sur la langue, bien connue. Comme ses consœurs elle est très soluble dans les graisses mais insoluble dans l’eau. Ce qui explique l’inutilité de boire de l’eau lorsqu’on ressent cette fameuse brulure…
Quant aux effets, on sait que la capsaïcine existe le système nerveux et produit des flots d’endorphines (l’hormone du bonheur) et qu’elle est aussi capable, paradoxalement, de soigner les ulcères à l’estomac. Également l’arthrite.
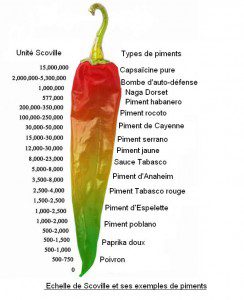
Il existe même une échelle de Scoville inventée en 1912 par le pharmacologue Wilbur Scoville. Son but est d’indiquer la teneur en capsaïcine des piments et donc leur puissance… Au feu !
Qui s’y frotte s’y pique !
 Et le thymol, le menthol, l’eucalyptol ? Et la muscade ? Ça pique aussi… Oui mais, c’est autre chose… Enfin, ça reste proche quand même… La suite au prochain numéro !
Et le thymol, le menthol, l’eucalyptol ? Et la muscade ? Ça pique aussi… Oui mais, c’est autre chose… Enfin, ça reste proche quand même… La suite au prochain numéro !
Double régression : je redeviens chimiste et je joue aux billes ! Allez, je vous laisse, je suis en train de cuisiner un curry Madras. Immangeable sauf par les initiés ! 🙂
Et, si vous êtes sages, je vous dirais comment je m’y prend pour faire ces portraits colorés de molécules…






0 commentaires